01Reseach overview
The loss of muscle mass and strength caused by skeletal muscle aging—known as sarcopenia—has become a major challenge to healthy living. Sarcopenia not only reduces physical strength but also directly impacts daily quality of life (QOL). To address this, it is essential to maintain both the "quantity" (muscle mass) and "quality" (muscle functionality) of skeletal muscle.
Skeletal muscle is far more than just a tool for movement. It is the body’s largest organ for energy metabolism, playing a key role in conditions such as type 2 diabetes. Additionally, skeletal muscle functions as a communication hub, sending signals through the bloodstream to regulate whole-body homeostasis, including brain and heart function.
Our research focuses on understanding the biological mechanisms that control both the quantity and quality of skeletal muscle. By uncovering these mechanisms, we aim to develop strategies to prevent and treat muscle diseases, including sarcopenia and genetic muscle disorders. At the same time, we are working to unlock the untapped potential of human skeletal muscle—pushing the boundaries beyond healthy aging to redefine its role in enhancing recovery, supporting other organs, and improving overall health and resilience.
1.Molecular regulation of muschle stem cell function
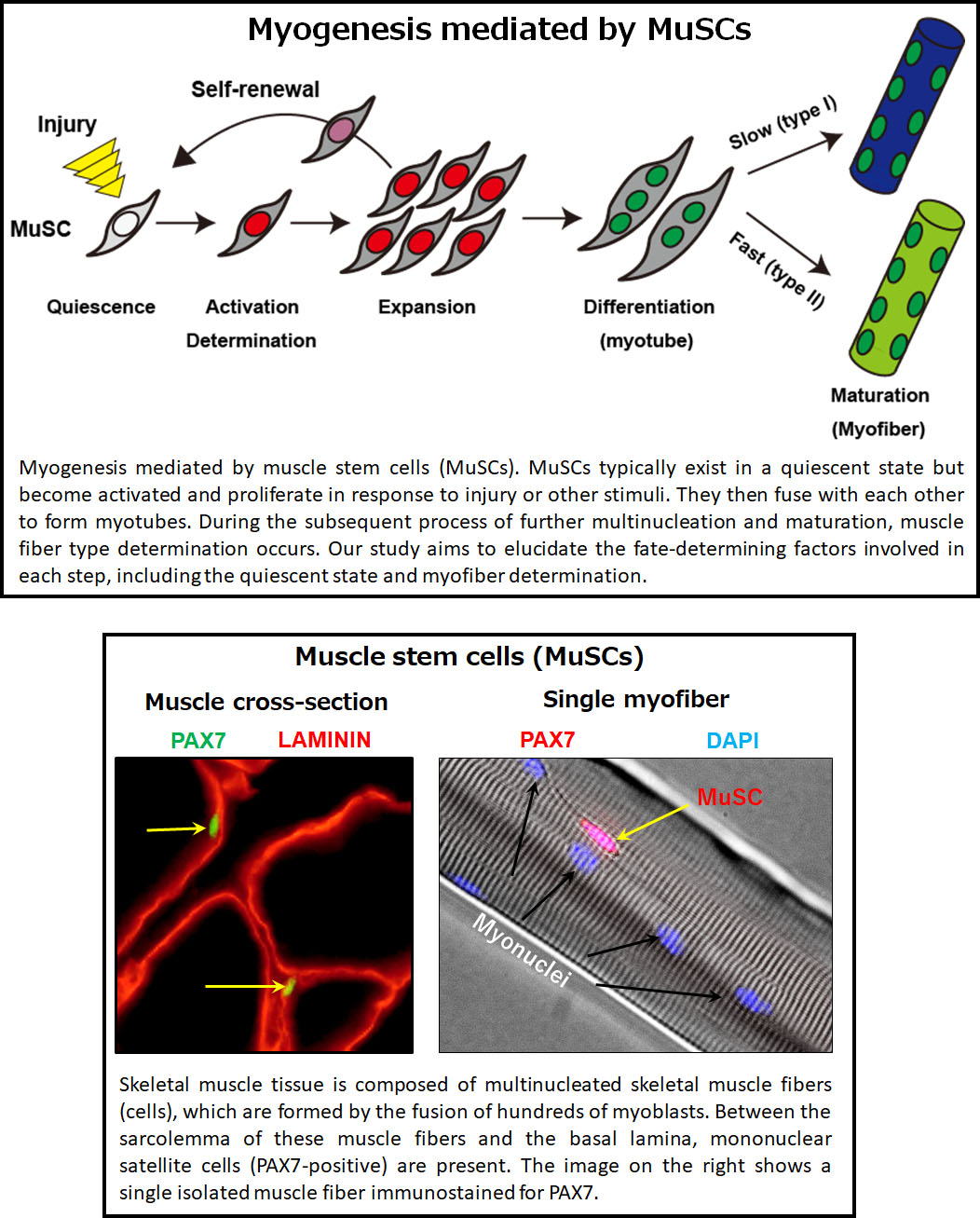
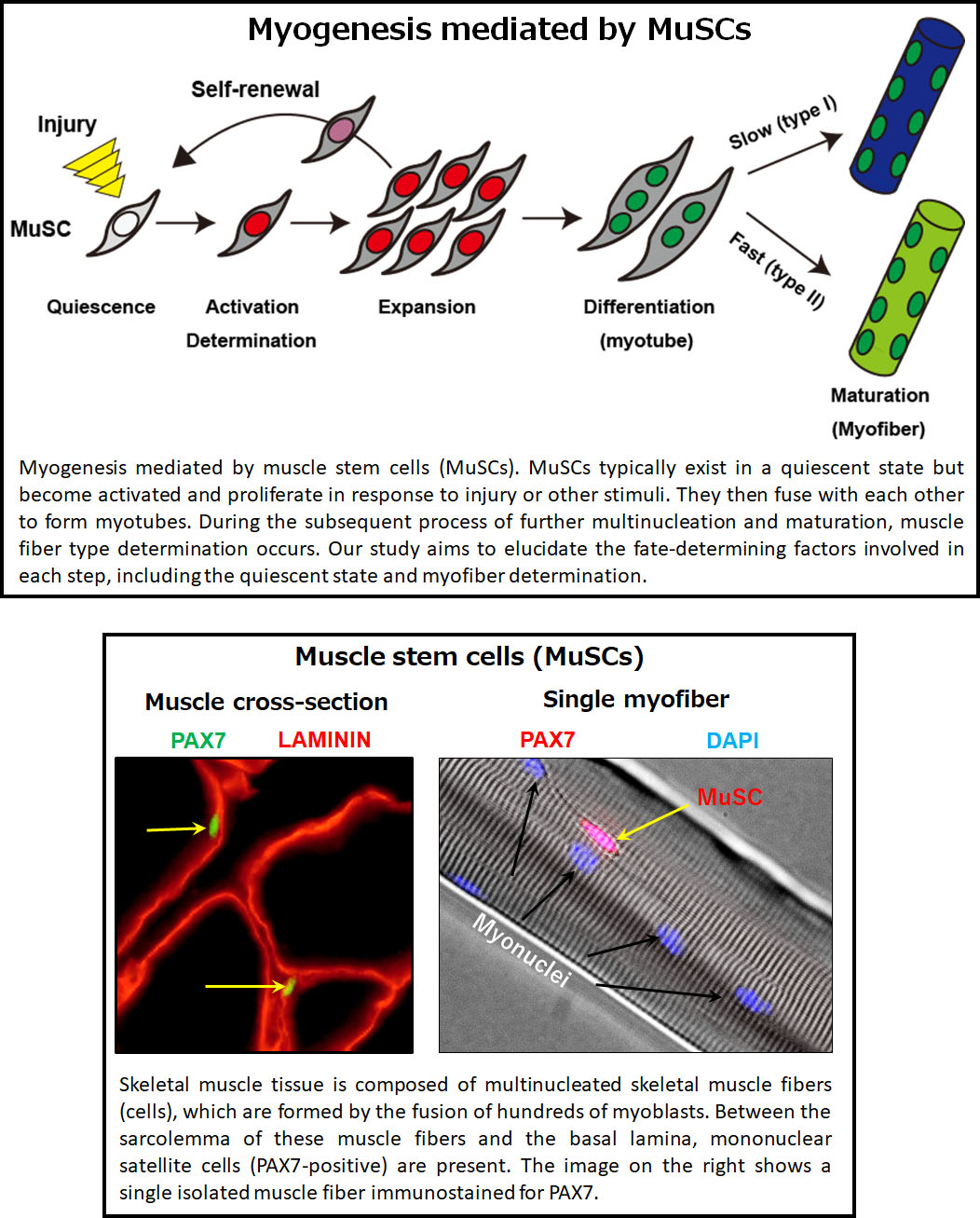
Muscle stem cells are essential to regenerating damaged or aging skeletal muscle. However, these cells don’t work alone—they rely on their surrounding environment, or "niche," to function properly. Much like people thrive in supportive communities, muscle stem cells interact with other cells to maintain their regenerative abilities.
Despite their importance, we still don’t fully understand how muscle stem cells interact with their environment. Our research focuses on uncovering these relationships, as they could pave the way for new approaches to maintaining muscle stem cells and even advancing stem cell therapies.
In addition, we’ve developed a unique mouse model that allows us to see the differences between individual muscle stem cells. Our findings suggest that these cells are not identical—they each have unique characteristics and roles. By studying this diversity, we aim to answer key questions: Why are muscle stem cells so different from each other? What does this mean for muscle health and regeneration? Ultimately, we hope to apply this knowledge to improve regenerative medicine.
2.Decoding What Makes Muscle Strong and Resilient
When we think about muscle health, we often focus on size—but the "quality" of muscle is just as important. Muscle fibers, the basic units of skeletal muscle, are formed when muscle stem cells multiply and fuse together. Over time, these fibers develop into different types, such as slow-twitch (Type I) fibers for endurance or fast-twitch (Type II) fibers for strength. Fast-twitch fibers can be further divided into subtypes (IIa, IIx, and IIb), each with its own characteristics.
The proportion of these muscle fiber types plays a major role in determining muscle strength, fatigue resistance, and even the risk of metabolic diseases. Interestingly, the composition of muscle fiber types varies widely between species, hinting at fascinating evolutionary and functional differences.
Our research explores the molecular "switches," that determine muscle fiber type. We’re also investigating how genetic differences, like single nucleotide polymorphisms (SNPs), influence muscle fiber composition and impact health. By understanding these mechanisms, we hope to not only improve muscle health but also uncover ways to enhance the capabilities of human skeletal muscles.

- Research Division Leader
- Associate Professor Fujita Ryo
01研究概要
超高齢化社会が進む現代、骨格筋の老化が原因となるサルコペニアは、健康寿命を大きく阻む課題の一つです。サルコペニアは筋肉量と筋力の低下を特徴とし、特に筋力の低下は日常生活の質(QOL)を直接的に低下させます。そのため、筋肉の「量」と「質」の両方を維持することが、健康な生活を支える鍵と考えられています。
骨格筋は身体を動かす役割に加え、体内で最も大きなエネルギー代謝臓器として、2型糖尿病などの代謝性疾患とも深く関係しています。さらに、骨格筋は「内分泌器官」としての役割も持ち、血流を介して他の組織と情報をやり取りすることで、認知機能や心機能を含む全身の健康や恒常性を調節していることが明らかになっています。
私たちの研究では、骨格筋の「量」と「質」を制御する分子基盤の解明を中心に、サルコペニアの予防や治療法の開発を目指しています。また、これらの基盤研究を通じて、ヒト骨格筋の進化的背景を探りながら、健康長寿の実現だけでなく、骨格筋の新たな機能拡張の可能性を追求しています。この目標を達成するため、以下のような研究テーマに取り組んでいます。
1.骨格筋を支える分子基盤の解明
骨格筋の再生を支える鍵となる「骨格筋幹細胞」の微小環境(ニッチ)と非均質性(Heterogeneity)に着目し、そのメカニズムを解明することを目指しています。骨格筋幹細胞は、骨格筋の再生に不可欠な存在ですが、単独ではその能力を最大限に発揮することができません。周囲の細胞や環境と共同することで、幹細胞としての性質を維持していると考えられています。
しかし、骨格筋組織内でどの細胞とどのように相互作用することが重要なのか、またそれを支える分子メカニズムについては十分に解明されていません。この微小環境に関する理解を深めることは、骨格筋幹細胞の維持や機能強化だけでなく、幹細胞移植医療の進展にもつながる可能性があります。
また私たちは、骨格筋幹細胞のHeterogeneityを可視化する独自のマウスモデルを開発しました。このツールを用いた研究により、骨格筋幹細胞は均一な集団ではなく、それぞれが異なる個性や機能を持つことが示唆されています。この非均質性の生理的意義を明らかにし、再生医療への応用を目指します。
2.骨格筋の質を制御する分子機構の解明
骨格筋の「量」だけでなく「質」を制御することは、健康で機能的な骨格筋を維持する上で重要です。骨格筋線維(筋細胞)は、幹細胞が増殖・融合することで形成され、その後、遅筋(Type I)と速筋(Type II)に成熟します。特に速筋(Type II)は、発現するミオシン重鎖(MyHC)の種類によってさらに細分化され、筋肉の質を表す主要な指標の一つです。
筋線維タイプの比率や多様性は、筋力や疲労耐性に影響するだけでなく、代謝性疾患リスクにも関与しています。また、動物種によって筋線維タイプの構成や特性が異なることから、その進化的背景や生物学的意義を探ることは非常に重要です。
私たちは、筋線維タイプを制御する転写因子や分子メカニズムを明らかにすることで、骨格筋の質を左右する仕組みを解明しています。さらに、ヒトにおける一塩基多型(SNP)に着目し、個体差が筋線維の特性や疾患リスクにどのように影響するかを研究しています。これらの成果は、骨格筋の進化的背景を解き明かすとともに、骨格筋のさらなる機能拡張を実現する基盤となると考えています。

- 藤田 諒 准教授


